2.1 海水中的氯
粗盐提纯
- 盐田法:
把海水引入盐田,利用日光、风力来蒸发浓缩海水,并进一步使食盐结晶出来的方法
-
粗盐提纯:
- 难溶性杂质:过滤
- 可溶性杂质:化学物质,沉淀(注意顺序:必须先加
再加 ) - 除去杂质后
纯度较高,称为精盐
电解饱和食盐水
- 化学方程式
- 阳极产生氯气,阴极产生氢气和氢氧化钠
- 氯碱工业:用电解饱和食盐水的方法制备氯气、氢气和烧碱,并以他们为原料生产一系列含氯、含钠化工产品的工业
氯气的性质
与金属反应
与金属点燃,生成金属氯化物。生成的金属氯化物中金属处于最高价态。
与铁单质反应
火星四射,生成黄褐色烟。
与铜单质反应
生成棕黄色烟。
与钠单质反应
发出黄光,生成白色固体。
与非金属反应
可以和部分非金属单质发生化合反应。
与氢气反应
安静燃烧,发出苍白色火焰,生成白雾。用于氯化氢的工业制法。
发生爆炸,生成白雾。
与磷反应
该反应是中学化学中唯一一个同时生成烟和雾的反应。
与硅反应
与还原性物质反应
与
与
与
与水反应
这将会制得氯水。
氯水
氯气溶于水的产物,会发生化学反应,但是是可逆的。
氯水分为新制氯水和久置氯水。
-
新制氯水因为氯气与水反应,其中主要成分有:
-
久置氯水由于次氯酸见光分解则可看作盐酸。
氯气的实验室制法
原理
用
装置
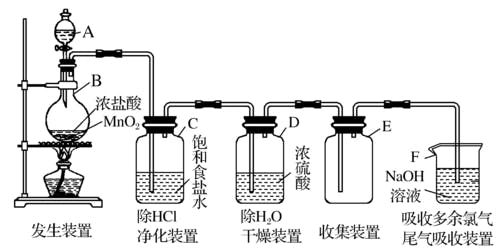
净化
用饱和食盐水除去气体中的
干燥
用浓硫酸(
尾气处理
用
次氯酸和次氯酸盐
次氯酸和次氯酸盐都是重要的含氯化合物。
次氯酸
次氯酸是一种很弱的酸,具有强氧化性,能杀死水中的细菌,起到消毒作用。次氯酸能使染料和有机色质褪色,可用作棉、麻和纸张等的漂白剂。次氯酸不稳定,易分解生成氧气,故一般只存在于稀溶液中。在阳光的照射下,次氯酸的分解速度加快。
次氯酸盐
次氯酸盐一般是由氯气和碱的反应得到的。由于次氯酸盐比次氯酸稳定,因此更容易保存。工业中,用氯气和氢氧化钠生产次氯酸钠,用氯气和消石灰制成漂白粉,这些制品常用作漂白剂和消毒剂。
漂白粉
漂白粉是次氯酸钙、氯化钙、氢氧化钙等所组成的混合物(有效成分是次氯酸钙),被广泛地用作饮用水、排泄物及环境的消毒剂,也可用于游泳池等公共场所的消毒。
如果漂白粉遇到酸性溶液或露置在空气中,其中的次氯酸钙会与酸或与水蒸气和二氧化碳发生反应,生成稳定性差的次氯酸,从而使漂白粉失效,因此漂白粉应密封保存。
这里的